热门搜索产品:
锂离子电池是一种高效、环保的电源,主要由正极、负极、电解液、隔膜和外壳组成。充电时,锂离子从负极脱出,经过电解液迁移到负极,并嵌入石墨层间。放电时,锂离子从正极移回负极,同时释放出电子供外部设备使用。
在现代科技飞速发展的时代,锂离子电池作为一种重要的能源存储技术,已经广泛应用于各类电子设备中。无论是手机、平板电脑还是电动车,锂离子电池都发挥着至关重要的作用。那么,锂离子电池究竟是如何工作的呢?本文将深入解析锂离子电池的工作原理,帮助大家更好地理解这种高效、环保的电源。
## 一、锂离子电池的基本构造
要了解锂离子电池的工作原理,首先需要熟悉其基本构造。一般来说,锂离子电池主要由以下几个部分组成:
- **正极(阴极)**:通常由锂金属氧化物制成,如钴酸锂(LiCoO₂)。
- **负极(阳极)**:一般采用石墨材料。
- **电解液**:通常是含锂盐的有机溶剂,负责传递离子。
- **隔膜**:位于正负极之间,防止短路的同时允许锂离子通过。
- **外壳**:用于封装上述组件,保护电池内部结构。
## 二、充电过程详解
当锂离子电池充电时,外部电源施加的电场使得锂离子从正极脱出,经过电解液迁移到负极,并在那里嵌入到石墨层间。具体步骤如下:
1. **锂离子脱出**:在电场作用下,正极材料中的锂离子脱离出来进入电解液。
2. **电子流动**:为了保持电荷平衡,相应的电子通过外电路流向负极。
3. **锂离子嵌入**:锂离子穿过电解液到达负极,并被吸入石墨层间形成LiC6化合物。
4. **能量储存**:随着越来越多的锂离子在负极聚集,电池储存的能量逐渐增加。
此过程中,正极反应可表示为:$LiCoO_2 \rightarrow Li_{1-x}CoO_2 + xLi^+ + xe^-$;负极反应为:$6C + xLi^+ + xe^- \rightarrow Li_xC_6$。总反应式为:$LiCoO_2 + 6C \rightarrow Li_{1-x}CoO_2 + Li_xC_6$。
## 三、放电过程详解
与充电相反,放电是指电池释放电能的过程。此时,锂离子从负极移回正极,同时释放出电子供外部设备使用。具体步骤如下:
1. **锂离子释放**:锂离子从负极石墨层间脱出进入电解液。
2. **电子流动**:电子通过外电路流回正极,产生电流。
3. **锂离子嵌入**:锂离子穿过电解液回到正极,并重新嵌入到正极材料中。
4. **能量释放**:随着锂离子不断返回正极,电池释放出储存的能量。
放电时,正极反应为:$Li_{1-x}CoO_2 + xLi^+ + xe^- \rightarrow LiCoO_2$;负极反应为:$Li_xC_6 \rightarrow 6C + xLi^+ + xe^-$。总反应式同样为:$LiCoO_2 + 6C \rightarrow Li_{1-x}CoO_2 + Li_xC_6$。
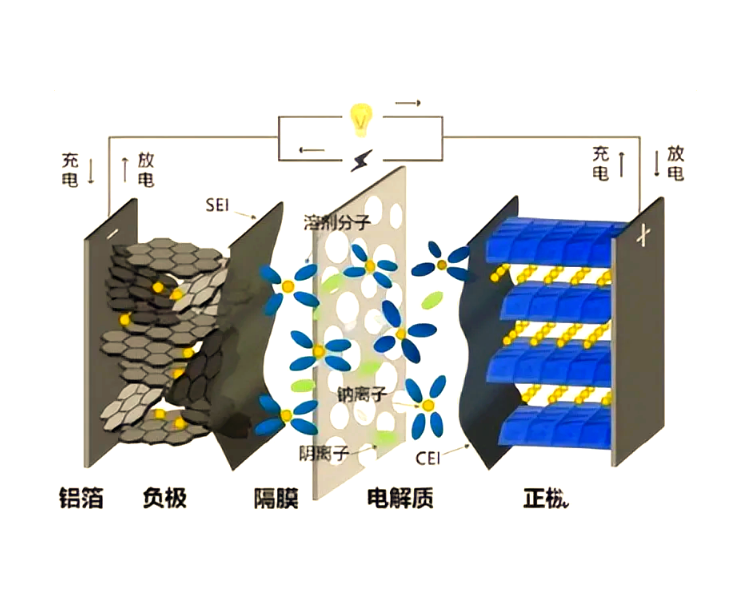
## 四、摇椅式电池的独特设计
锂离子电池有时被称为“摇椅式电池”,这是因为在充放电过程中,锂离子就像在正负极之间来回摆动的椅子一样不断移动。这种设计确保了电池具有较高的能量密度和较长的使用寿命。此外,由于锂离子是在电极材料内部进行嵌入和脱出,而不是像传统铅酸电池那样发生化学反应,因此锂离子电池几乎没有记忆效应,维护起来也更加方便。
## 五、锂离子电池的优势与挑战
### 1. 优势
- **高能量密度**:相比其他类型的电池,锂离子电池能够存储更多的能量,使其特别适合用于需要长时间供电的便携式电子产品。
- **长寿命**:正确的使用和维护下,锂离子电池可以经历数百次甚至上千次的充放电循环而不显著损失性能。
- **低自放电率**:即使长时间不使用,锂离子电池也能保持较高的电量,减少了频繁充电的需求。
- **环保友好**:不含有毒重金属如镉或汞,对环境的影响较小。
### 2. 挑战
尽管锂离子电池有许多优点,但它也面临着一些挑战:
- **成本较高**:相比于一些传统电池技术,锂离子电池的成本相对较高,这可能会限制其在某些领域的应用。
- **安全性问题**:如果处理不当,例如过充、过放或者物理损坏,锂离子电池可能会发热甚至起火燃烧。因此,需要配备专门的保护电路来确保安全运行。
- **资源限制**:虽然锂元素在地壳中的分布相对广泛,但高品质的锂矿资源仍然有限,且开采难度较大。此外,钴等其他关键原材料的供应也存在不确定性。
锂离子电池凭借其卓越的性能成为了当今社会不可或缺的一部分。通过对其工作原理的理解,我们可以更好地利用这些强大的小能量包,同时也要注意解决它们带来的挑战。未来,随着新材料的发展和技术创新的应用,相信锂离子电池将在更多领域展现出更大的潜力。
上一篇:笔记本反向充电危害大吗
下一篇:电动工具电池充电原理图
 扫一扫 关注微信
扫一扫 关注微信
 打开手机网站
打开手机网站